INTRODUCCIÓN
estos días se ha constatado el apogeo de la
informática y electrónica que ha dado lugar a la automatización de tareas y
procesos llevados a cabo enteramente por intervención humana, con el avance
tecnológico en forma exponencial que existe en el presente, se han ido
desarrollando computadoras con mayor y mejor capacidad de procesamiento de
datos, haciéndolas más autónomas y, llevándose a una analogía con los seres
humanos, haciendo que estas computadoras lleguen a ser “inteligentes”. En
consecuencia, ha surgido la rama de la ingeniería denominada como “Inteligencia
Artificial”, cuya principal finalidad es la de servir a la humanidad en la
ejecución de tareas que resultan complejas para los seres humanos y brindar
asistencia en procedimientos críticos o delicados como es el caso de la
detección de cáncer de piel tipo melanoma dentro del campo de la medicina y que
es objeto de este trabajo de investigación.
Según Mezquita [1] el melanoma es una de las
afecciones más agresivas en lo que a cáncer de piel se refiere ya que produce
alrededor del 75% de las muertes por cáncer de piel en España según revela el
Registro Nacional de Melanoma Cutáneo; hasta el año 2002 la OMS (Organización
Mundial de la Salud) estimaba que 20.000 personas menores de 55 años en los países
miembros de la Unión Europea (UE) padecían esta enfermedad. Para la American
Cancer Society [2] el melanoma, a pesar de ser un tipo de cáncer poco
frecuente, tiene una alta tasa de mortalidad ya que es mucho más probable que
se propague a otras partes del cuerpo si no se combate a tiempo. El
procedimiento normal para la detección temprana de melanoma se realiza a través
de imágenes dermatoscópicas que capturan estructuras cutáneas invisibles a
simple vista o con fotografías convencionales, y se lleva a cabo solamente por
dermatólogos especializados.
En consecuencia, Marín et al. [3] manifiesta que
se han implementado numerosos algoritmos y modelos de inteligencia artificial
para replicar de forma automática y eficiente el procedimiento de detección de
melanoma. Adegun & Viriri [4] dice que la utilización de la inteligencia
artificial en la detección de melanoma aún debe enfrentar varios desafíos, por
tal motivo, se alienta a investigadores de todo el mundo a contribuir con esta
temática. Tal afirmación ha sido la motivación para desarrollar este trabajo
investigativo.
Las redes neuronales convolucionales CNN han
jugado un papel preponderante en el desarrollo de modelos predictivos de
imágenes debido a su estupenda capacidad de procesarlas, por tal motivo, este
trabajo se centrará en implementar un modelo CNN y a partir de él, realizar
modificaciones y aplicar otras técnicas, tecnologías y/o herramientas con el
anhelo de mejorar los resultados obtenidos hasta el momento. La predicción de
la que se habla en un modelo predictivo, consiste en acercarse en la mayor
medida posible a la realidad en función de lo ocurrido en el pasado, en tal
virtud, el modelo realiza un entrenamiento con datos conocidos y aprende a
identificar ciertos aspectos que establecen que dichos datos pertenezcan a una
u otra categoría; concretamente en este proyecto, el modelo aprende a reconocer
factores que determinen el hecho de que una lesión cutánea pertenezca a la
categoría de melanoma para luego, en base a este aprendizaje, poder predecir
con la mayor precisión posible si una futura lesión cutánea puede catalogarse
como melanoma. El entrenamiento se realiza con un dataset debidamente procesado
cuyas imágenes se obtuvieron gratuitamente de la plataforma de ISIC dedicada a
almacenar imágenes dermatoscópicas para este tipo de proyectos.
Los modelos construidos en este trabajo de
investigación se comparan con los del estado del arte y lamentablemente no se
consiguieron los resultados esperados, la causa probable para ello, fue el
hecho contar con recursos computacionales limitados, principalmente la memoria
RAM que no permitió trabajar con un tamaño lo suficientemente grande en las
imágenes de entrada.
Antecedentes
En la actualidad, en sintonía con los avances
científicos y tecnológicos, se ha vuelto común la utilización de herramientas
computacionales para llevar a cabo tareas de la medicina, entre ellas el
diagnóstico de cáncer de piel mediante el análisis de lesiones cutáneas que
eventualmente podrían transformarse en melanomas; el empleo de estas
metodologías modernas y automáticas, además suponen un avance en el accionar de
los profesionales médicos ya que representan una optimización en el tiempo y
esfuerzo dedicado comparadas con las metodologías manuales convencionales.
En consecuencia, han surgido numerosos modelos de
deep learning para el tratamiento de imágenes dermatoscópicas que han ofrecido
magníficos resultados pero que aún enfrentan desafíos y dificultades debido a
la unicidad y complejidad de cada paciente.
La aplicación de modelos de inteligencia
artificial para la detección de melanoma ha visto la luz en proyectos
realizados, por ejemplo, por Rangel-Cortes et al. [5], donde efectúan la
clasificación de melanomas a través de CNN empleando tres técnicas: la primera
mediante la añadidura de metadatos sobre edad, género y tamaño del melanoma
comparada con un análisis sin añadir dichos metadatos, la segunda con imágenes
netamente del melanoma eliminando la piel de alrededor y la tercera con una
entrada de 2.000 imágenes sin pre-procesamiento de 300x300 píxeles. La
precisión predictiva real alcanzada por el modelo fue: 77.50% sin metadatos,
77.50% con metadatos, 67.50% sin la piel que rodea el melanoma y 80.00% sin un
pre-procesamiento en las imágenes entrantes.
Abhinav & Dheeba [6] desarrollaron un
clasificador mediante la implementación de CNN y basado en una arquitectura de
Transfer Learning con la finalidad de trabajar sobre los avances logrados por
otros modelos construidos previamente, tales modelos fueron: Inception v3,
InceptionResNet v2 y ResNet 152; la base de datos empleada en el entrenamiento
y posterior evaluación de este modelo fue la proporcionada por ISIC; el modelo
alcanzó un 93.50% de precisión predictiva.
Yu et al. [7] aplicaron una CNN en 724 imágenes
dermatoscópicas de melanomas acrales y nevos benignos obtenidas de manos y pies
de los pacientes, dichas imágenes estuvieron clasificadas en 350 imágenes de
melanomas de 81 pacientes y 374 imágenes de nevos benignos de 194 pacientes; la
precisión predictiva lograda por el modelo fue del 83.51% en verdaderos positivos
y 80.23% en verdaderos negativos.
Nasiri et al. [8] propusieron un enfoque de
clasificación de lesiones cutáneas para la detección de melanoma bajo un
sistema de razonamiento basado en casos CBR (Case-Based Reasoning) con la
finalidad de recuperar nuevas imágenes de entrada desde la base de datos
original y obtener un nuevo conjunto de entrenamiento más organizado y fácil de
entender para el modelo que fue construido con 16 capas convolucionales, este
modelo se entrenó utilizando imágenes del dataset de ISIC utilizándose 1.346
imágenes para el entrenamiento y 450 para la evaluación; la precisión de
predicción alcanzada fue del 75.00%.
Mahecha et al. [9] desarrollaron una GPU (Graphic
Processing Unit) para el análisis de imágenes clínicas de la piel cuyo
funcionamiento se basa en un sistema de redes neuronales con distintos módulos
encargados de tareas específicas tales como la detección de la silueta del
melanoma y el estudio del contorno del mismo para determinar el diagnóstico
médico final; los resultados obtenidos en este proyecto son de una precisión
predictiva del 76.67% en la detección de melanomas y un 74.07% en lesiones
cutáneas benignas.
Adegun & Viriri [4] enlistan una serie de
proyectos exitosos que se detallan a continuación:
Alqudah et al. [10] desarrollaron un modelo
empleando la técnica de transfer learning de las arquitecturas GoogleNet y
AlexNet, el optimizador utilizado fue ADAM; el modelo se probó con el dataset
de ISIC con imágenes segmentadas y no segmentadas, para el primer caso se alcanzó
una predicción de clasificación del 92.20% y para el segundo caso la predicción
llegó al 89.80%.
El-Khatib et al. [11] construyeron un sistema
donde integraron las arquitecturas de GoogleNet, ResNet-101 y NasNet-Large
pre-entrenadas en extensas bases de datos como ImageNet y Places365, también
utilizaron un SVM (Support Vector Machine) para la detección de características
obteniendo altos valores de precisión en la diferenciación entre melanomas y
nevos benignos.
Almaraz-Damian et al. [12] implementaron un
sistema donde el pre-procesamiento de imágenes se llevó a cabo mediante la
regla ABCD, la extracción de características se realizó a través de una CNN, el
sistema fue cotejado con otras técnicas de clasificación como Regresión Lineal,
Support Vector Machine (SVM) y Relevant Vector Machines (RVM); al evaluarse con
el dataset de ISIC el modelo logró buenos resultados en la detección de
melanomas.
Yuan & Tavildar [13] elaboraron un modelo
llamado SegAN que consiste en dos partes: un segmentador y la red como tal, el
segmentador genera un mapa de probabilidades en cada imagen de entrada de ser o
no ser una lesión cutánea (que potencialmente pudiere convertirse en melanoma),
mientras tanto, la red separa o clasifica los dos tipos de entradas; este modelo
alcanzó una precisión predictiva del 93.70%.
Hao et al. [14] construyeron un modelo con una
arquitectura de red tomada del modelo Deep-lab, pre-entrenada mediante PASCAL
VOC-2012 y empleando métodos de bagging sobre modelos VGG16, U-net, DenseNet y
Inception v3; obtuvo una precisión predictiva del 94.50% entrenándose con
20.000 iteraciones.
Molina-Moreno et al. [15] diseñaron una red
híbrida entre FCN (Fully Convolutional Network) y una RPN elíptica (Region
Proposal Network) para la segmentación automática de lesiones cutáneas (que
pudieren convertirse en melanomas); el modelo FCN provee una segmentación
acertada píxel por píxel de la imagen mientras que el modelo RPN extrae una
segmentación a baja resolución de las zonas elípticas del potencial melanoma;
este proyecto contó con el 94.70% de precisión predictiva.
Zhou et al. [16] efectuaron un ensemble de algunos
modelos de deep learning del estado del arte como: DenseNet121, Se-ResNext50,
Se-ResNext101, EfficientNet-B2, EfficientNet-B3 y EfficientNet-B4 aplicando la
técnica del transfer learning; obtuvieron una precisión predictiva del 78.00%.
Pachecoa et al. [17] realizaron un ensemble de
varios clasificadores CNN, los cuales son: SENet, PNASNet, InceptionV4,
ResNet-50, ResNet-101, ResNet-152, DenseNet-121, DenseNet-169, DenseNet-201,
MobileNetV2, GoogleNet, VGG-16 y VGG-19; cada uno de estos clasificadores se
adaptaron para tareas específicas; el modelo fue pre-entrenado con ImageNet y
logró una precisión predictiva del 89.20%.
Chouhan [18] empleó el modelo DenseNet-161
pre-entrenado con el dataset ImageNet para clasificar lesiones cutáneas; la
precisión de predicción obtenida fue del 87.00%.
Dat et al. [19] emplearon los modelos CNN
EfficientNet e Inception ResNet del estado del arte para solucionar
inconvenientes de desbalance de los datos de entrada, previnieron el
overfitting con técnicas de muestreo ascendente y una función novel loss;
alcanzaron una precisión predictiva del 87.20%.
Zhang [20] formuló un modelo de deep learning llamado
MelaNet usando como base una capa densa de 169 neuronas, empleó una función
softmax y una función sigmoid para establecer la no linealidad requerida, este
modelo fue concebido a partir de una arquitectura Fully Connected con una capa
de salida de 8 unidades para construir clasificadores multi-clase; la precisión
de predicción alcanzada fue del 89.70%.
Xing et al. [21] propone un ensemble de modelos
con la misma estructura y entrenados con los mismos hiperparámetros, tal
ensemble alcanzó una precisión predictiva del 75.40%.
Yousef & Motahari [22] emplearon 7 modelos con
la base de datos ImageNet para desarrollar un clasificador, los modelos usados
fueron: DenseNet121, InceptionV3, InceptionResNetV2, Xception, EfficientNetB1,
EfficientNetB2 y EfficientNetB3; la precisión predictiva del clasificador fue
del 88.50%.
Cohen & Shimoni [23] utilizaron técnicas de
ensemble de modelos y generaron otros modelos desde diferentes puntos de vista,
partieron con la construcción de un algoritmo que obtiene relaciones entre los
atributos de entrada y los atributos objetivo, luego crearon un Diversity
Generator para generar diversos modelos y un Combiner para combinar los
resultados de todos los modelos, finalmente implementaron CNN para entrenar
mediante loss functions y test-time augmentation; la capacidad predictiva que
obtuvieron fue del 88.40%.
Material y métodos
El desarrollo de este trabajo de
investigación se basa en una comparativa de soluciones al problema planteado de
utilizar la inteligencia artificial para detectar melanomas, partiendo de
modelos basados en redes neuronales convolucionales CNN; de modo que, se
pretende evaluar la precisión, efectividad y confiabilidad de los modelos
existentes, con los modelos que se implementan en este trabajo investigativo.
Finalmente, se buscan aportar nuevas técnicas, tecnologías y/o herramientas que
pudieren mejorar la efectividad actual con la que cuenta el campo de la
detección automática de melanomas.
CONTRIBUCIÓN
La implementación de la inteligencia
artificial en el campo de la medicina, concretamente, en la detección de
melanoma ha abierto un mar de conocimiento por explorar; en virtud de ello,
este proyecto ha pretendido adentrarse en este nuevo mundo para intentar
aportar un grano de arena en el entendimiento de este conocimiento que se ha
develado.
Mediante la utilización de los recursos
computacionales que estuvieron al alcance, se constató que el procesamiento de
imágenes dermatoscópicas para detectar melanomas requiere una gran capacidad en
memoria RAM, puesto que las características que definen una lesión cutánea como
melanoma o no, son muy finas, en consecuencia, el modelo predictivo debe contar
con muchas capas convolucionales en el caso de ser una CNN, pero sobretodo, las
imágenes de entrada al modelo deben ser lo suficientemente grandes para lograr
encontrar estas diferencias entre “melanoma” y “no melanoma” que pueden darse
en un solo píxel.
Se implementó también un modelo basado en la
arquitectura Vision Transformer que ha venido dando buenos resultados en la
clasificación de imágenes, sin embargo, no se obtuvieron los resultados
deseados a causa de la limitación de memoria RAM, por tal motivo, se detalla
una línea de trabajo futuro en la sección VII enfatizando la consecución de más
recursos informáticos.
Resultados y discusión
A continuación, se describen los resultados
obtenidos en cada uno de los 5 modelos implementados en este proyecto.
Modelo inicial
Este modelo es el fruto de experimentar con
múltiples hiperparámetros, luego de un considerable número de intentos y
ensayos, este modelo resultó ser el más óptimo de este proyecto. Por
limitaciones de memoria no se pudo establecer un tamaño de entrada de imágenes
mayor a 64x64 píxeles. Este modelo alcanzó una precisión del 62.54%.
En la Figura 1 se realiza una comparativa de
precisión “accuracy” entre las etapas de entrenamiento, validación y evaluación
del modelo inicial
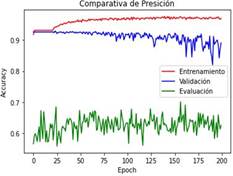
Figura 1. Curvas que describen la métrica de “accuracy” en el
modelo inicial durante el entrenamiento (color rojo), validación (color azul) y
evaluación (color verde) del modelo inicial en el transcurso de las 200
“epochs” establecidas.
Modelo 1: Data augmentation
La diferencia de este modelo respecto al
modelo inicial, valga la redundancia, es que se aplicó la técnica de “data augmentation”.
La precisión alcanzada por este modelo fue del 56.62%.
En la Figura 2 se realiza una comparativa de
precisión “accuracy” entre las etapas de entrenamiento, validación y evaluación
del modelo 1
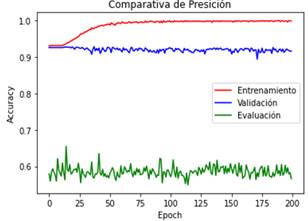
Figura 2. Curvas que describen la métrica de “accuracy” en el
modelo 1 durante el entrenamiento (color rojo), validación (color azul) y
evaluación (color verde) del modelo inicial en el transcurso de las 200
“epochs” establecidas.
Modelo 2: Menor dataset
La primera diferencia de este modelo respecto
al modelo inicial, valga la redundancia, es que se empleó un dataset con un
menor número de imágenes, 5.170 para entrenar y 1.164 para evaluar. La
precisión alcanzada por este modelo fue del 54.12%.
En la Figura 3 se realiza una comparativa de
precisión “accuracy” entre las etapas de entrenamiento, validación y evaluación
del modelo 2.
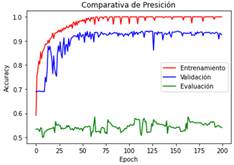
Figura 3. Curvas que describen la métrica de “accuracy” en el
modelo 2 durante el entrenamiento (color rojo), validación (color azul) y
evaluación (color verde) del modelo inicial en el transcurso de las 200
“epochs” establecidas.
Modelo 3: Menor dataset y mayor tamaño de
imágenes
La primera diferencia de este modelo respecto
al modelo inicial, valga la redundancia, es que se incrementó el tamaño de las
imágenes de entrada de 64x64 a 128x128 píxeles, que fue el valor máximo
permitido por la memoria RAM otorgada por Google Colaboratory. La segunda
diferencia es que se utilizó el dataset de imágenes usado por el modelo 2, es
decir, 5.170 imágenes para entrenar y 1.164 para evaluar. La precisión
alcanzada por este modelo fue del 54.47%.
En la Figura 4 se realiza una comparativa de
precisión “accuracy” entre las etapas de entrenamiento, validación y evaluación
del modelo 3.
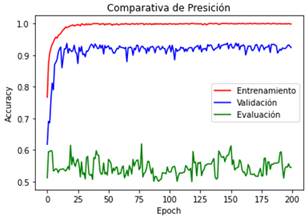
Figura 4. Curvas que describen la métrica de “accuracy” en el
modelo 3 durante el entrenamiento (color rojo), validación (color azul) y
evaluación (color verde) del modelo inicial en el transcurso de las 200
“epochs” establecidas.
Modelo 4: Vision Transformer ViT
Este modelo se construyó reemplazando las
redes neuronales convolucionales por la arquitectura Vision Transformer, se
empleó el mismo dataset que el modelo 2 y 3, es decir, 5.170 im para entrenar y
1.164 para evaluar. La precisión alcanzada por este modelo fue del 50.00%.
En la Figura 5 se realiza una comparativa de
precisión “accuracy” entre las etapas de entrenamiento, validación y evaluación
del modelo 4
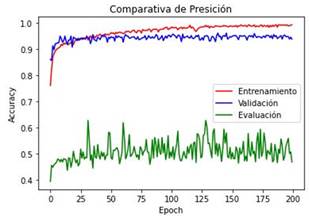
Figura 5. Curvas que describen la métrica de “accuracy” en el
modelo 4 durante el entrenamiento (color rojo), validación (color azul) y
evaluación (color verde) del modelo inicial en el transcurso de las 200
“epochs” establecidas.
DISCUSIÓN
Se pudo constatar que las redes neuronales
convolucionales CNN son efectivas en la clasificación de imágenes, sin embargo,
en este proyecto las imágenes tienen bastantes similitudes entre sus
categorías, dicho de otro modo, las imágenes catalogadas como “melanoma” se
parecen en muchos aspectos a las imágenes catalogadas como “no melanoma”; esto
conllevó a que sea bastante difícil para los modelos, poder diferenciar
adecuadamente los factores que definen a una imagen como “melanoma” y como “no
melanoma”, en consecuencia, no se obtuvieron buenas clasificaciones y por lo
tanto, no se consiguió el objetivo central de construir modelos para la
detección de melanomas a partir de imágenes dermatoscópicas puesto que, para
que un detector sea considerado como tal, debe contar con una precisión
bastante alta, quizá en el orden del 95% o superior, mientras que la máxima
precisión obtenida en este proyecto fue del 62.54%.
La capacidad predictiva de redes neuronales
convolucionales y modelos de inteligencia artificial en general, obtiene
mejores resultados conforme existe un mayor número de datos para el
entrenamiento, por tal motivo, se armó un dataset con 22.457 imágenes para
entrenar y 1.164 imágenes para evaluar, que son valores relativamente altos,
tales imágenes tienen tamaños variables que llegan hasta 6708x4419 píxeles; los
modelos construidos en este proyecto admiten un tamaño estandarizado constante
para todas las imágenes, por consiguiente, se redujo el tamaño a 64x64 píxeles
que fue el máximo permitido por los recursos computacionales con los que se
trabajó; dichos recursos fueron proporcionados gratuitamente por la plataforma
Google Colaboratory y extraoficialmente se sabe que otorga alrededor de 12 GB
de memoria RAM para ejecutar notebooks; en consecuencia, las imágenes con las
que se entrenaron los modelos, resultaron demasiado pequeñas considerando que
existen bastantes similitudes entre la categoría “melanoma” y “no melanoma”;
además, dada esta limitación de recursos, no se pudo implementar un mayor
número de capas convolucionales, que en teoría, ayudaría a mejorar el
rendimiento del modelo. Por ello, el modelo inicial que trabajó con este
dataset obtuvo una precisión del 62.54%. De manera que, se afirma con un alto
valor de confianza que el rendimiento de los modelos construidos en este
proyecto aumentaría si se utiliza una mayor capacidad de memoria RAM ya que esto
permite un mayor tamaño de las imágenes de entrada y así el modelo podrá
identificar con mayor detalle aquellas características que establecen que una
lesión cutánea sea catalogada como “melanoma” y como “no melanoma”; además, se
podría contar con más capas convolucionales.
A fin de reducir costos computacionales, se
construyó un dataset menor con 5.170 imágenes para entrenar y 1.164 imágenes
para evaluar y se realizaron ensayos con el mismo; el resultado fue el modelo 2
en el que se comprobó que con 4 capas convolucionales el modelo alcanza su
mejor rendimiento, es decir, al incorporar más capas convolutivas, el modelo no
adquiere mejoras sustanciales. La precisión predictiva alcanzada por este
modelo fue del 54.12%, lo cual era esperado puesto que se entrenó con un menor
número de imágenes que el modelo inicial que logró una precisión del 62.54%.
El dataset menor pudo emplearse en imágenes
de mayor tamaño dando lugar al modelo 3 que trabajó con imágenes de 128x128
píxeles a diferencia de los modelos anteriores que trabajaron con imágenes de
64x64 píxeles. La precisión predictiva lograda mejoró un poco respecto al
modelo 2, subió al 54.47%; esto confirmaría la afirmación de que, con un mayor
tamaño en las imágenes de entrada, se pueden obtener mejores resultados.
En vista del inconveniente de la limitación
de recursos informáticos, principalmente de la memoria RAM, se buscaron
herramientas que traten de solucionar esta problemática, esto llevó a
implementar el modelo 4 aplicando la técnica de “Vision Transformer ViT” en
lugar de redes neuronales convolucionales CNN, dicho sea de paso, no se
encontró en el estado del arte trabajos previos que hayan utilizado esta
técnica para la detección de melanomas. Los resultados obtenidos fueron
bastante parecidos a los resultados del modelo 3, tomando en cuenta que se
utilizaron exactamente el mismo dataset, es decir, 5.170 imágenes para
entrenar, 1.164 imágenes para evaluar y un tamaño para las imágenes de entrada
de 128x128 píxeles, la precisión alcanzada por el modelo 4 fue del 51.20%; esto
significa que la arquitectura “Vision Transformer ViT” para clasificar imágenes
podría convertirse en un buen competidor para las CNN. Sin embargo, no ayudó a
mejorar los resultados del presente trabajo de investigación, se podría afirmar
que nuevamente se debió al hecho de trabajar con un tamaño demasiado pequeño en
las imágenes de entrada.
En el caso del modelo 1 se agregó una etapa
de “data augmentation” al modelo inicial pero no se consiguieron buenos
resultados sino al contrario, esto podría explicarse tal vez porque las
modificaciones que hace esta técnica a las imágenes dermatoscópicas no
contribuyen en una mejor identificación y diferenciación de características por
parte del modelo.
Conclusiones
Se implementaron un total de cinco modelos de
inteligencia artificial para la detección de melanomas, para todos ellos se
utilizó un dataset compuesto enteramente de imágenes dermatoscópicas debido a
su capacidad de capturar estructuras cutáneas imperceptibles a simple vista o
con fotografías convencionales, dichas imágenes se obtuvieron del sitio web de
ISIC y tienen tamaños de hasta 6708x4419 píxeles.
Se realizó una búsqueda en el estado del arte
en la temática de la inteligencia artificial en la detección de melanomas donde
se encontraron varios trabajos exitosos que llegan a obtener una precisión
predictiva de hasta el 93.50%. Además, se hallaron varias técnicas
complementarias a las redes neuronales convolucionales que han contribuido
exitosamente a la predicción de melanoma alcanzando precisiones de hasta el
94.70%
En total se construyeron cuatro modelos
basados en redes neuronales convolucionales, el que mejores resultados produjo
es el modelo inicial con una capacidad predictiva del 62.54%. Además, se
implementó un modelo bajo la arquitectura Vision Transformer ViT como sustituto
de las CNN y alcanzó una predicción del 51.20%.
El principal problema encontrado en el
desarrollo de este trabajo de investigación fue el de las limitaciones de
recursos computacionales, especialmente de memoria RAM, que al trabajar en la
plataforma de Google Colaboratory, se limita su uso con la finalidad de proveer
sus servicios a usuarios de todo el mundo de forma gratuita.
La limitación de memoria RAM conllevó a que
se trabaje con un tamaño excesivamente pequeño para las imágenes de entrada, de
64x64 píxeles para el modelo inicial y modelo 1, y de 128x128 para el modelo 2,
modelo 3 y modelo 4. Con un alto grado de confianza se puede decir que esto
provocó que no se obtengan buenos resultados puesto que las imágenes
catalogadas como “melanoma” y “no melanoma” guardan bastantes similitudes, en
consecuencia, a los modelos predictivos se les dificulta diferenciar aquellas
características que definen una u otra categoría.
La limitación de memoria RAM llevó también a
que no se puedan implementar un mayor número de capas convolucionales en el
modelo inicial, esto podría haber ayudado a conseguir mejores resultados. Sin
embargo, en el modelo 2 se implementaron varias capas convolutivas y a partir
de la cuarta no se obtuvieron mejoras significativas; por lo tanto, se vuelve a
afirmar el hecho de que las imágenes de entrada fueron demasiado pequeñas.
El modelo 4 que se implementó a través de la
herramienta Vision Transformer ViT demostró ser tan eficiente como las CNN
puesto que obtuvo resultados parecidos al modelo 3; ambos modelos trabajaron
exactamente con el mismo dataset.
Una ventaja de la arquitectura Vision
Transformer ViT respecto a las CNN es su menor consumo de recursos
computacionales, sin embargo, no se pudo incrementar el tamaño de las imágenes
de entrada y permaneció en 128x128 píxeles.
Debido a las limitaciones de memoria RAM no
se pudo combinar varios modelos y probar resultados.
Referencias bibliográficas
[1]E. Mezquita,
“Detección de melanomas con inteligencia artificial,” Diario Médico, p. 12, 13
Enero 2014.
[2]American Cancer
Society, “¿Qué avances hay en las investigaciones sobre el cáncer de piel tipo
melanoma?,” 14 Agosto 2019. [En línea]. Available:
https://www.cancer.org/es/cancer/cancer-de-piel-tipo-melanoma/acerca/nuevas-investigaciones.html#escrito_por.
[3]C. Marín, G. H. Alférez, J.
Córdova y V. González, “Detection of melanoma through image recognition and
artificial neural networks,” IFMBE Proceedings, vol. 51, pp. 832-835, 7-12
Junio 2015.
[4]A. Adegun y S. Viriri, “Deep
learning techniques for skin lesion analysis and melanoma cancer detection: a
survey of state-of-the-art,” Artificial Intelligence Review, 27 Junio 2020.
[5]J. J.
Rangel-Cortes, J. S. Ruiz-Castilla, F. García-Lamont y J. Cervantes-Canales,
“Redes Neuronales Convolucionales en la identificación de melanomas benignos y
malignos,” Revista Ibérica de Sistemas e Tecnologias de Informação, nº E23, pp.
15-27, Octubre 2019.
[6]S. Abhinav y J. Dheeba,
“Convolutional Neural Network for Classifying Melanoma Images,” 2020.
[7]C. Yu, S. Yang, W. Kim, J. Jung,
K.-Y. Chung, S. W. Lee y B. Oh, “Acral melanoma detection using a convolutional
neural network for dermoscopy images,” PloS ONE, vol. 13, nº 3, p. e0193321, 24
Abril 2018.
[8]S. Nasiri, J. Helsper, M. Jung y
M. Fathi, “DePicT Melanoma Deep-CLASS: a deep convolutional neural networks
approach to classify skin lesion images,” BMC Bioinformatics, vol. 21, nº 84,
11 Marzo 2020.
[9]M. S. S. Mahecha, O. J. S. Parra
y J. B. Velandia, “Design of a System for Melanoma Detection Through the
Processing of Clinical Images Using Artificial Neural Networks,” Challenges and
Opportunities in the Digital Era, vol. 11195, pp. 605-616, 12 Octubre 2018.
[10]A. M. Alqudah, H. Alquraan y I.
A. Qasmieh, “Segmented and non-segmented skin lesions classification using
transfer learning and adaptative moment learning rate technique using
pretrained convolutional neural network,” Journal of Biomimetics, Biomaterials
and Biomedical Engineering, vol. 42, pp. 67-78, 2019.
[11]H. El-Khatib, D. Popescu y L.
Ichim, “Deep learning-based methods for automatic diagnosis of skin lesions,”
Sensors, vol. 20, nº 6, p. 1753, 2020.
[12]J. A. Almaraz-Damian, V.
Ponomaryov, S. Sadovnychiy y H. Castillejos-Fernandez, “Melanoma and nevus skin
lesion classification using handcraft and deep learning feature fusion via
mutual information measures,” Entropy, vol. 22, nº 4, p. 484, 2020.
[13]Q. Yuan y S. Tavildar, “An open
solution to ISIC 2018 classification and segmentation challenges,” 2018.
[14]D. Hao, J. Y. Seok, D. Ng, N.
K. Yuan y F. M, “ISIC Challenge 2018,” 2018.
[15]M. Molina-Moreno, I.
González-Díaz y F. Díaz-de-María, “An elliptical shape-regularized
convolutional neural network for skin lesion segmentation,” 2018.
[16]S. Zhou, Y. Zhuang y R. Meng,
“Multi-category skin lesion diagnosis using dermoscopy images and deep CNN
ensembles,” 2019.
[17]A. G. C. Pachecoa, A. R. Alib y
T. Trappenber, “Skin cancer detection based on deep learning andentropy to
detect outlier samples,” 2019.
[18]V. Chouhan, “Skin lesion
analysis towards melanoma detection with deep convolutional neural network,”
2019.
[19]T. Dat, D. T. Lan, T. T. H.
Nguyen, T. T. N. Nguyen, H. P. Nguyen, L. Phuong y T. Z. Nguyen, “Ensembled
skin cancer classification (ISIC 2019 challenge submission),” 2019.
[20]P. Zhang, “MelaNet: a deep
dense attention network for melanoma detection in dermoscopy images,” 2019.
[21]J. Xing, C. Zeng, H. Yangwen,
W. Tao, Y. Mao, S. Wang, Y. Zheng y R. Wang, “Open-set recognition of
dermoscopic images with ensemble of deep convolutional networks,” 2019.
[22]Z. M. Yousef y H. Motahari,
“Skin lesion analysis towards melanoma detection using softmax ensemble model
and sigmoid ensemble model,” 2019.
[23]S. Cohen y N. Shimoni, “TTA
meta learning for anomaly detection on skin lesion,” 2019.
,
Geovanny Euclides Silva Peñafiel2
,
Victor Alfonso Cusco Vinueza2
,
Paco Jovanni Vasquez Carrera2